Tregs
2025 Nobel Prize in Physiology or Medicine ... "For the Discovery of Peripheral Immune Tolerance"

면역계는 몸을 수많은 종류의 병원체로부터 지켜내는 역할을 한다. 이 과정에서, 몸의 일부와 병원체의 구별은 핵심적이다. 2025년 노벨위원회(The Nobel Committee) 의 노벨 생리의학상은 자신의 몸을 향한 공격을 억제하는 방안을 발견한 Mary E. Brunkow 박사, Fred Ramsdell 박사, 그리고 Shimon Sakaguchi 박사에게 수여되었다. Brunkow 박사와 Ramsdell 박사는 자가면역질환이 있는 쥐를 연구했으며, Shimon Sakaguchi 는 조절 T세포의 식별을 연구했다. 수십년간의 면역 세포 간 상호작용, 가슴샘의 역할, 자가면역 쥐의 돌연변이 유전자, 면역을 억제하는 여러 단백질 등에 대한 연구로 조절 T세포가 발견되고 그 특징이 규명될 수 있었다[1].
Timeline
|
1945 |
Ray Owen이 소 태아에서 쌍둥이끼리 피와 혈액줄기세포가 섞이면 평생 거부반응이 없음을 보인다[2]. |
|
1948 |
Astrid
Fagraeus가 Plasma cell 에서 항체가 만들어짐을 보인다[3,4]. Snell이 생쥐를 교배하고 암을 이식하면서 MHC 유전자(H-2)를 발견한다[5]. |
|
1949 |
Scurfy 변이가 탄생한다[6]. |
|
1957 |
Burnet이 항체의 다양성의 기원은 항체수준이 아닌 세포수준에서 이루어짐을 주장한다[7]. |
|
1959 |
Russel,
Russel, Gower이 scurfy 쥐를 연구하며 돌연변이의 근원이
x염색체에 있음을 알게된다[8]. |
|
1961 |
Jacques
Miller이 어린 쥐에서 가슴샘(Thymus) 를 제거하면 면역결핍이 일어남을
보인다[9]. |
|
1973 |
Penhale 등이 어린 쥐에서 가슴샘 제거 이후 자가면역질환의 발생을 보인다[10]. |
|
1973 경 |
Doherty and
Zinkernagel이 항원-T세포 상호작용과 MHC 사이의 관련성이 존재함을 처음으로 드러낸다[11–13]. |
|
1976 경 |
Tonegawa 박사가 유전자 재조합의 과정을 밝혀낸다[14,15]. 이는 현재V(D)J
재조합이라 불린다. |
|
1985 경 |
CD4+ T cell 과 CD8+ T cell 의 인식의 차이가 MHC를
관련해 제시된다[16]. |
|
1987-1995 |
CTLA-4 가 있음이 보여지며 그 역할이 KO 쥐 등으로 규명된다[17,18]. |
|
1987 |
Kappler,
Roehm, Marrack등이 Negative selection 이 있음을 실험적으로
처음으로 보인다[19]. |
|
1992 |
B7-CD28
cositmulation 이 밝혀진다[20,21]. |
|
1995 |
Sakaguchi등이 CD4+ CD25+ T세포가 있음을 보이며, 조절 기능이 있다는 점을 발견한다[22]. |
|
1997 |
두 팀이 거의 비슷한 시기에 인슐린을 통해 현재 AIRE이라 불리는 TF를 찾는다[23]. |
|
2000 |
Takahashi 등이 CTLA-4이 CD4+, CD25+ T 세포의
기능에 중요하다는 점을 발견한다[24]. |
|
2001 |
Brunkow 등이 범위를 좁혀서 Foxp3를 찾아내고, 명명하며
쥐 교배를 통해 이 유전자의 결핍이 쥐의 자가면역질환의 원인임을 보인다[25]. Brunkow,
Ramsdell 등이 FOXP3의 변이가 사람에 자가면역질환
IPEX를 일으킴을 보인다[26]. mTEC 가 여러 항원들을 제시하는 것이 보여지며[27], 이 메커니즘은
Central tolerance 로 알려진다. |
|
2003 |
Hori, Nomura,
Sakaguchi가 Treg 에 Foxp3 가 발현됨을 보인다[28]. |
면역학의 (본격적) 시작 및 발전
면역학의 실제 시작은 기록이 없고 엄청난 과거여서 다루기 힘들며, 면역학, 의술, 본능의 경계가 굉장히 구분하기 힘들어진다. 대표적으로, 원숭이의 일종에서 병에 걸린 흔적이 보일때 서로간 접촉을 줄인다는 연구[29]가 있으며, 이는 어떻게보면 본능이고 어떻게보면 사회보건학의 산물이다. 이후, 약 9세기 즈음에는 vaccination 이전의 방법인, 바이러스를 변형없이, 바이러스가 일반적으로 침투하지않는 부분에 주는 variolation이 진행되었다는 연구도 있다[30].
현대 면역학의 초기에는 쉽게 생각할 수 있는 박테리아, 바이러스에 대한 면역 반응이 아닌, 의외로 기관 이식에 대한 연구가 중요했다. Ray Owen의 한 연구는, 성장한 소에서 피가 섞이면 몸이 이를 reject하지만, 소 태아에서 피가 섞이면 그대로 받아들임을 보였다[2]. 이에, 면역은 본질적으로 있는것이 아닌, 점차 성장하는것임을 처음으로 암시했다. 면역학에서 하나의 의외의 발견은 1948년 Snell의 발견이다. Snell은 쥐에서 피부조직이식을 실험하면서 쥐에서 특정 유전자가 이것을 결정한다는 점을 발견했으며, 그 유전자를 H-2라 명명했다. 당시 Snell은 자신이 발견한 그 분자가 면역 작용에서 핵심적인 역할을 하는 점은 상상하지 못했을 것이다[5]. 1961년 Miller의 발견 이후 정체불명이었던 가슴샘(Thymus)의 역할이 점점 나타나면서 이에 관련해 T세포에 대한 조사 역시 진행된다. 이 두 트랙을 연결시킨 것은 Doherty 와 Zinkernagel의 1973년 연구로, H-2가 있어야만 T세포와 다른 세포가 상호작용할 수 있음을 보였다(이제 MHC restriction 이라 불린다). 이전에는 H-2의 생물에서의 역할이 불분명했으며, 그들은 “…surely the system had not developed just to frustrate transplantation surgeons” 라고 당시 상황을 회상한다. [11–13] 이후, H-2는 우리가 모두 아는 친숙한 이름의 MHC로 개명된다.
1976년, 일본의 Tonegawa박사는 면역 세포에서 유전자가 섞이는(재조합되는) 메커니즘을 발견하게된다. 현재 V(D)J재조합이라고 알려진 이 반응의 발견은 예상되지 않은 큰 혁신이었다. 이제, 어떻게 한정된 유전자로 수많은 박테리아, 바이러스 등을 인식하는지, 그리고 이에 대응하는 항체가 만들어질 수 있는지가 뚜렷히 보이게 된다. 하지만, 이러면 자신에 있는 단백질과 반응하는 세포나 항체가 만들어질 가능성이 존재하며, 자연스럽게 이에 대한 연구가 진행된다.
Regulatory T cell 의 발견
B 세포와 T세포의 유전자 재조합의 무작위성이 밝혀진 이후[14], 면역 억제 작용에 대한 연구가 진행된다. 가장 먼저 진행된 연구 중 하나는 CD28 – B7 결합에서 CD28과 경쟁하는 CTLA-4 의 억제성 역할의 발견이었다[17,18]. 그러나, CTLA-4가 있다는점만으로는 구체적인 세포를 찾아내기 힘들었다.
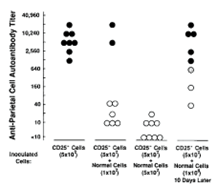
이후 1995년, Sakaguchi박사는CD4+ T세포 중 면역을 억제하는 T 세포의 구체적인 표면 마커를 찾는 와중 면역을 억제하는 CD25+ T 세포를 마침내 발견하고 ‘Immunologic Self-Tolerance Maintained by Activated T Cells Expressing IL-2 Receptor (alpha)-Chains (CD25)’ 라는 논문에 출판한다. Sakaguchi는 세포 결핍 쥐(nu mice)에 CD4+ CD25+ T 세포를 제외한 T세포들을 주입 시 자가면역질환을 관찰할 수 있었으며, T 세포 결핍 쥐에게 고정된 수의 CD25- 세포에 정상적인 세포를 넣을수록 자가면역질환이 억제된다는 점을 실험으로 보았다. Sakaguchi의 1995년 논문에 나온 위 그림을 보면, 쥐에 CD25+세포를 제외한 세포를 주었을 때는 자가면역질환이 발생했지만(가장 왼쪽 열의 점), 일반적인, 즉 CD25+세포를 거르지 않은 세포를 더 넣었을때에는(두번째열, 세번째열의 점) 자가면역질환이 적게 발생함을 알 수 있다. 아래의 표는 다양한 비율의 일반적 CD4+세포와 CD25+세포를 제외시킨 세포를 다양한 비율로 nu mice에 주며, 다양한 자가면역질환의 발병을 보인것이다. 자가면역질환 관계없이, CD25+세포가 적을수록 더 발병이 흔한것을 볼 수 있다.[22] 이로써 처음으로 면역반응을 조절하는 CD4+ CD25+ Treg 가 구체적으로 드러나게 된다. 한 후속 연구로, 2000년, Takahashi 와 Sakaguchi 등은 CD4+, CD25+ T 세포에 CTLA-4 가 존재함을 보인다[24].

Scurfy 쥐 및 Foxp3의 발견
CD25는 조절T세포의 한 표면마커로 중요했지만 아직 완전히 조절 T세포를 찾기는 어려웠다. 특히, CD25는 일반적인 CD4+ T 세포에서 흔한 IL-2R 의 일부였다. 이때, 과학자들은 당시 알려져있던 한 종료의 쥐와 연관지을 수 있었다. Scurfy 쥐는 미국의 맨해튼 프로젝트 도중 방사능이 동물에 미치는 영향을조사하는 과정에서 만들어진 돌연변이 쥐로, 의외로 역사가 오래되었다[6]! Scurfy 쥐는 심한 자가면역질환을 앓았다. W. L. Russel 등은 이 돌연변이 쥐를 1959년에 연구하며 쥐를 야생형과 교배시켜 돌연변이가 X 염색체에 있음을 발견했다[8]. 수십년 뒤, Brunkow 등은 이 쥐를 다시 연구하며 시퀀싱을 통해 돌연변이의 위치가 있을 가능성의 유전자 20여개의 500,000 염기쌍을 찾는다. 마침내 scurfy 쥐에서 돌연변이한 유전자를 발견하며, 전산적 분석으로 Forkhead 전사인자들과의 유사성으로 유전자를 Foxp3 라 명명한다[25]. Brunkow 와 Ramsdell 은 이후 IPEX 질환을 가지고있는 사람들의 가계도와 유전자를 분석하며 Foxp3 에서의 변이가 원인이라는 점을 밝힌다[26]. 요약하자면, 이들은 Foxp3유전자의 돌연변이가 자가면역질환을 일으킴을 보였다. (그림: [25] 원논문 캡쳐, X염색체 위 Scurfy 유전자의 위치)

이후 Hori, Nomura, Sakaguchi 는 마침내 Foxp3 가 Treg 에 존재함을 보인다. (그림: [28] 원논문 캡쳐, Foxp3에 결합하는 fluorescent probe를 사용해 Foxp3가 CD4+ CD25+세포에서만 발현됨을 보인다.) 더 나아가, 이들은 Foxp3를 T세포에 넣었을때 나타나는 형태가 실제 CD4+ CD25+ Treg 와 비슷함을 보였다[28].

Current Understanding and Future Prospects
Treg 의 세부 그룹으로 여러가지가 밝혀졌다. 먼저, Treg 는 가슴샘에서 발달한 tTreg 와 조직에서 생기는 pTreg 로 나누어질 수 있음이 보여졌다. 가슴샘에서 비롯되는 tTreg 는 일반 T 세포에 비해 TCR 이 자신의 항원과 더 강하게, 그러나 Negative-selection 이 되지 않을 정도의 적당한 세기로 상호작용할때 발생하는 것으로 보이며, pTreg 는 일반적인 Foxp- CD4+ 세포가 TGF-beta 자극을 받으면 생길 수 있음이 보여졌다. 이후 Treg 와 일반적 T 세포가 서로 변할 수 있는지 역시 연구가 진행되고 있다[31]. Treg 가 면역을 조절하는 방법 역시 여러가지가 밝혀졌다. 예시로, 면역 억제성 물질인 TGF-beta, IL-35, IL-10 등의 생산, 그리고 수지상세포와의 CTLA-4 결합으로 수지상세포를 억제하는 메커니즘이 보여졌다. 또한, Granzyme A등을 활용해 직접 effector T 세포를 죽이는 메커니즘 역시 존재한다는 점이 밝혀지고 더욱 최근에는 대사 과정을 방해하는 방안 역시 제시된다[32]. 다만, 아직 Treg 의 발생 과정은 tTreg 및 pTreg 모두 완전히 규명되지 못했으며, Treg 가 다른 T 세포에 어떤 영향을 미치는지 역시 더 연구가 필요해보인다. Treg에 대한 연구는 매우 활발하며, 장기 이식 이후 사람에 투입해 면역거부반응을 억제하는 연구 등 수많은 연구가 현재 진행되고 있다[33,34].
Comments
노벨 과학상 포스터를 위해 약 1주일 전부터 다양한 자료를 조사했으나, 결국 상을 타지 못해 아쉽다. 면역학 전반에 대해 알아보고, 이 발견에 직결되는 Treg관련 발견들에 대해 수 시간동안 찾아보고 수많은 리뷰논문을 통해 더욱 많은 원논문을 찾아보아 면역학 전반의 타임라인, Scurfy변이의 타임라인, 그리고 Treg 및 다양한 관련 메커니즘 발견의 타임라인을 만들었지만 말이다. 이 글이 아마도 Logicae 글 중 가장 많은 참고 문헌이 있는 글 일 것이다. 비록 목표는 달성하지 못했으나, 그 과정에서 면역학의 전반에 대한 역사를 알게 되었으며, 현재 면역학에서 주목받고있는 Treg에 대해 더 알 수 있어서 의미있는 시간이었던 것 같다. 이 글은 Logicae라는 블로그 형식에 맞추어 기존 포스터에서 수정을 했다. 또한, 포스터의 단점으로 꼽힌 그림 및 도표의 부재를 보완했다. 포스터는 PDF양식으로 첨부한다.
References & Additional Resources
1. The Nobel Prize Foundation. Scientific background to the Nobel Prize in Physiology or Medicine 2025 (pdf).
2. Owen RD. Immunogenetic Consequences of Vascular Anastomoses between Bovine Twins. Science. 1945;102(2651):400–1.
3. Fagraeus A. Plasma Cellular Reaction and its Relation to the Formation of Antibodies in vitro. Nature. 1947 Apr;159(4041):499–499.
4. Kugelberg E. Searching for the antibody producers. Nat Immunol. 2016 Dec;17(1):S7–S7.
5. Snell GD. Methods for the study of histocompatibility genes. Journ of Genetics. 1948 Oct 1;49(2):87–108.
6. Ramsdell F, Ziegler SF. FOXP3 and scurfy: how it all began. Nat Rev Immunol. 2014 May;14(5):343–9.
7. Burnet FM. A Modification of Jerne’s Theory of Antibody Production using the Concept of Clonal Selection. CA: A Cancer Journal for Clinicians. 1976 Mar 1;26(2):119–21.
8. Russell WL, Russell LB, Gower JS. EXCEPTIONAL INHERITANCE OF A SEX-LINKED GENE IN THE MOUSE EXPLAINED ON THE BASIS THAT THE X/O SEX-CHROMOSOME CONSTITUTION IS FEMALE. Proc Natl Acad Sci U S A. 1959 Apr;45(4):554–60.
9. Miller JFAP. IMMUNOLOGICAL FUNCTION OF THE THYMUS. The Lancet. 1961 Sept 30;278(7205):748–9.
10. Penhale WJ, Farmer A, Mckenna RP, Irvine WJ. Spontaneous thyroiditis in thymectomized and irradiated Wistar rats. Clin Exp Immunol. 1973 Oct;15(2):225–36.
11. Doherty PC, Zinkernagel RM. A BIOLOGICAL ROLE FOR THE MAJOR HISTOCOMPATIBILITY ANTIGENS. The Lancet. 1975 June 28;305(7922):1406–9.
12. Zinkernagel RM, Doherty PC. Restriction of in vitro T cell-mediated cytotoxicity in lymphocytic choriomeningitis within a syngeneic or semiallogeneic system. Nature. 1974 Apr;248(5450):701–2.
13. Zinkernagel RM, Doherty PC. The discovery of MHC restriction. Immunology Today. 1997 Jan 1;18(1):14–7.
14. Hozumi N, Tonegawa S. Evidence for somatic rearrangement of immunoglobulin genes coding for variable and constant regions. Proc Natl Acad Sci USA. 1976 Oct;73(10):3628–32.
15. Tonegawa S. Somatic generation of antibody diversity. Nature. 1983 Apr;302(5909):575–81.
16. Townsend ARM, Gotch FM, Davey J. Cytotoxic T cells recognize fragments of the influenza nucleoprotein. Cell. 1985 Sept 1;42(2):457–67.
17. Bashyam H. CTLA-4: From conflict to clinic. J Exp Med. 2007 June 11;204(6):1243.
18. Brunet JF, Denizot F, Luciani MF, Roux-Dosseto M, Suzan M, Mattei MG, et al. A new member of the immunoglobulin superfamily—CTLA-4. Nature. 1987 July;328(6127):267–70.
19. Kappler JW, Roehm N, Marrack P. T cell tolerance by clonal elimination in the thymus. Cell. 1987 Apr 24;49(2):273–80.
20. Harding FA, McArthur JG, Gross JA, Raulet DH, Allison JP. CD28-mediated signalling co-stimulates murine T cells and prevents induction of anergy in T-cell clones. Nature. 1992 Apr;356(6370):607–9.
21. Turka LA, Linsley PS, Lin H, Brady W, Leiden JM, Wei RQ, et al. T-cell activation by the CD28 ligand B7 is required for cardiac allograft rejection in vivo. Proc Natl Acad Sci USA. 1992 Nov 15;89(22):11102–5.
22. Sakaguchi S, Sakaguchi N, Asano M, Itoh M, Toda M. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases. J Immunol. 1995 Aug 1;155(3):1151–64.
23. Hanahan D. Peripheral-antigen-expressing cells in thymic medulla: factors in self-tolerance and autoimmunity. Current Opinion in Immunology. 1998 Dec 1;10(6):656–62.
24. Takahashi T, Tagami T, Yamazaki S, Uede T, Shimizu J, Sakaguchi N, et al. Immunologic Self-Tolerance Maintained by Cd25+Cd4+Regulatory T Cells Constitutively Expressing Cytotoxic T Lymphocyte–Associated Antigen 4. The Journal of Experimental Medicine. 2000 July 17;192(2):303–10.
25. Brunkow ME, Jeffery EW, Hjerrild KA, Paeper B, Clark LB, Yasayko SA, et al. Disruption of a new forkhead/winged-helix protein, scurfin, results in the fatal lymphoproliferative disorder of the scurfy mouse. Nat Genet. 2001 Jan;27(1):68–73.
26. Bennett CL, Christie J, Ramsdell F, Brunkow ME, Ferguson PJ, Whitesell L, et al. The immune dysregulation, polyendocrinopathy, enteropathy, X-linked syndrome (IPEX) is caused by mutations of FOXP3. Nat Genet. 2001 Jan;27(1):20–1.
27. Derbinski J, Schulte A, Kyewski B, Klein L. Promiscuous gene expression in medullary thymic epithelial cells mirrors the peripheral self. Nat Immunol. 2001 Nov;2(11):1032–9.
28. Hori S, Nomura T, Sakaguchi S. Control of Regulatory T Cell Development by the Transcription Factor Foxp3. Science. 2003 Feb 14;299(5609):1057–61.
29. Wren B, Ray IS, Remis M, Gillespie TR, Camp J. Social contact behaviors are associated with infection status for Trichuris sp. in wild vervet monkeys (Chlorocebus pygerythrus). Chaline N, editor. PLoS ONE. 2021 Apr 21;16(4):e0240872.
30. Boylston A. The origins of inoculation. J R Soc Med. 2012 July;105(7):309–13.
31. Lee W, Lee GR. Transcriptional regulation and development of regulatory T cells. Exp Mol Med. 2018 Mar;50(3):e456–e456.
32. Vignali DAA, Collison LW, Workman CJ. How regulatory T cells work. Nat Rev Immunol. 2008 July;8(7):523–32.
33. Romano M, Tung SL, Smyth LA, Lombardi G. Treg therapy in transplantation: a general overview. Transplant International. 2017;30(8):745–53.
34. Daniele N, Scerpa MC, Landi F, Caniglia M, Miele MJ, Locatelli F, et al. Treg cells: Collection, processing, storage and clinical use. Pathology - Research and Practice. 2011 Apr 15;207(4):209–15.
Comments ()