리튬 이온 전지의 원리와 전지 수명 감소 요인

스마트폰을 쓰다 보면 배터리 수명이 감소하고 있다는 느낌을 자주 받는다. 처음에는 하루 종일 충전을 하지 않아도 쌩쌩했지만, 나중에는 1시간만 사용해도 배터리가 완전히 방전된 적도 많다.
그러면 우리 스마트폰에 내장된 배터리 수명의 수명이 왜 가면 갈수록 깎일까? 그 해답은 바로 우리가 사용하는 리튬 이온 배터리의 구조에 있다.
산화 환원 반응과 화학 전지의 구조
보통 산화라 하면 철이 녹스는 것을 많이 떠올린다.

화학에서는 산소가 붙는 것 이외의 반응에도 산화라는 개념을 적용한다. 어떤 분자에 산소가 붙거나, 수소가 떨어져 나가거나, 어떤 원자에 전자가 방출되면 "산화"되었다고 한다. 그 반면에, 산소가 떨어져 나가거나, 수소가 붙거나, 전자가 붙으면 "환원"되었다고 한다.
실생활에서 산화-환원 반응이 활용되는 예시로는 화학 전지(배터리!!)가 있다. 복잡할 거 같지만, 화학 전지는 전극 2개, 전해질, 염다리로 정리된다. 먼저, 산화 전극(Anode)은 이름 그대로 산화 반응이 일어난다. 산화 전극 반대편에는 환원 전극이 있는데, 환원 전극(Cathode)에서는 환원 반응이 일어난다. 산화 전극은 전자를 방출하고, 환원 전극은 전자를 먹기 때문에, 전자는 산화 전극에서 환원 전극으로 흐른다. 따라서, 산화 전극은 화학 전지에서 (-)극이고, 환원 전극은 (+)극이다.
또한, 반응이 진행되어 각 전극에 전하 불균형이 발생한다. 각 수용액이 전하를 띄게 된다면 전극 간의 전기적 퍼텐셜이 발생해 전자가 도선으로 잘 흐르지 못하게 된다. 따라서, 전기적 중성을 유지하기 위해 두 전극 간의 이온 통로인 염다리(Salt Bridge)가 필요하다. 참고로, 위에서 말한 수용액을 다른 말로 전해질(Electrolyte)이라고 부른다.
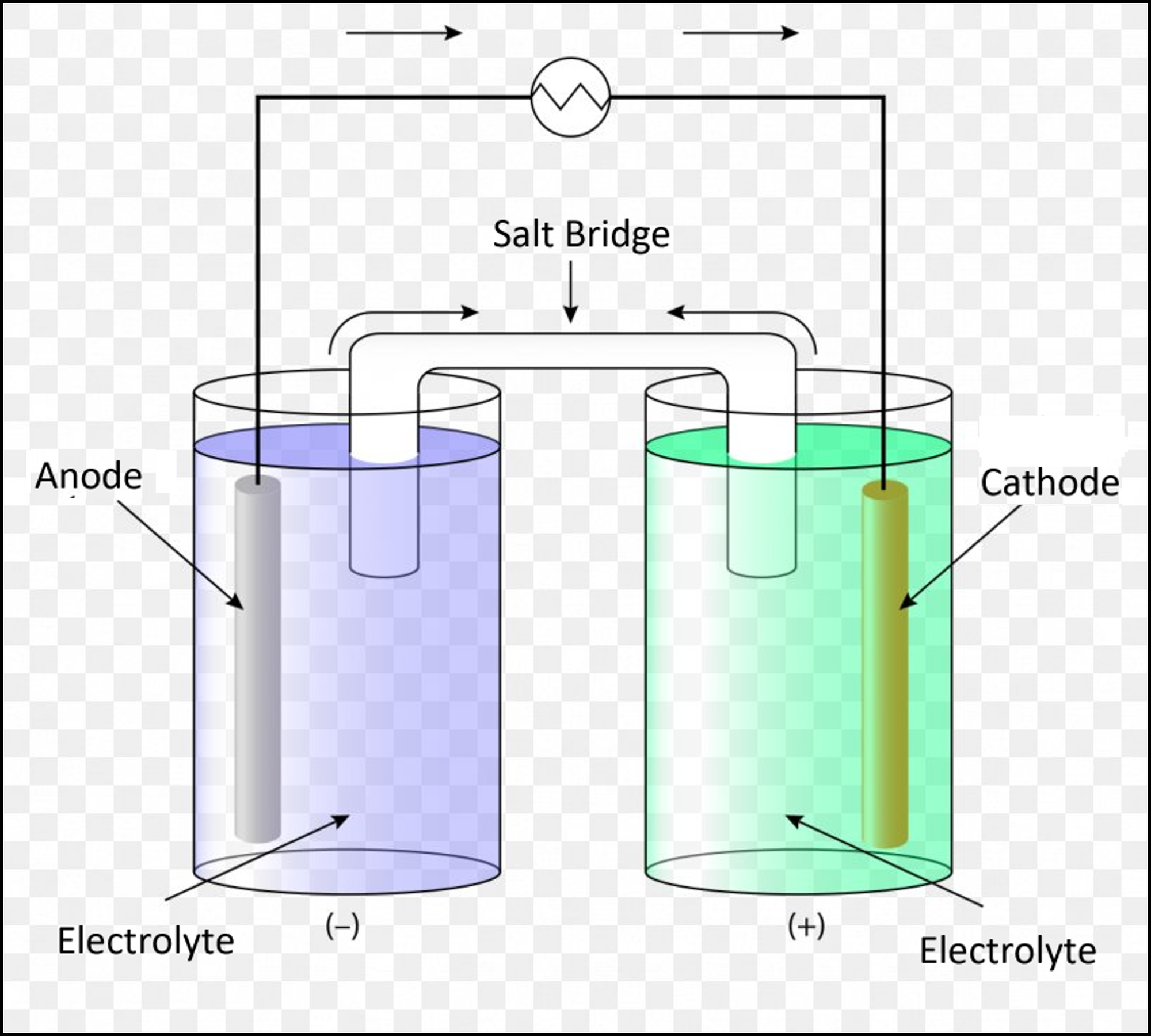
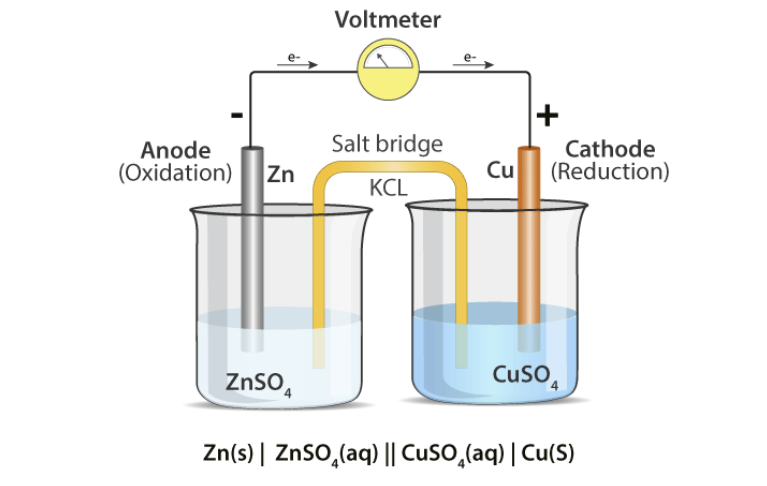
아연-구리 전지의 예시를 들어보자. 아연-구리 전지는 $ZnCl_{2}$ 수용액에 아연 전극, $CuCl_{2}$ 수용액에 구리 전극을 담그고 전선으로 연결한 화학 전지다. 2가 구리 이온이 2가 아연 이온보다 더 환원되려는 경향이 있기 때문에, 각 전극에서 일어나는 반응은 다음과 같다.
산화 전극: $Zn \rightarrow Zn^{2+} + 2e^{-}$
환원 전극: $Cu^{2+} + 2e^{-} \rightarrow Cu$
하지만, 반응이 진행되면 진행될수록 산화 전극 쪽에서는 양이온 수가 감소하고, 환원 전극 쪽에서는 양이온이 점차 많아지기 때문에, 산화 전극의 수용액은 음전하를 띄게 되고, 환원 전극의 수용액은 양전하를 띄게 된다. 이를 상쇄해주기 위해 염다리로 우묵가사리, KCl 같은 물질을 쓴다.
리튬 이온 전지
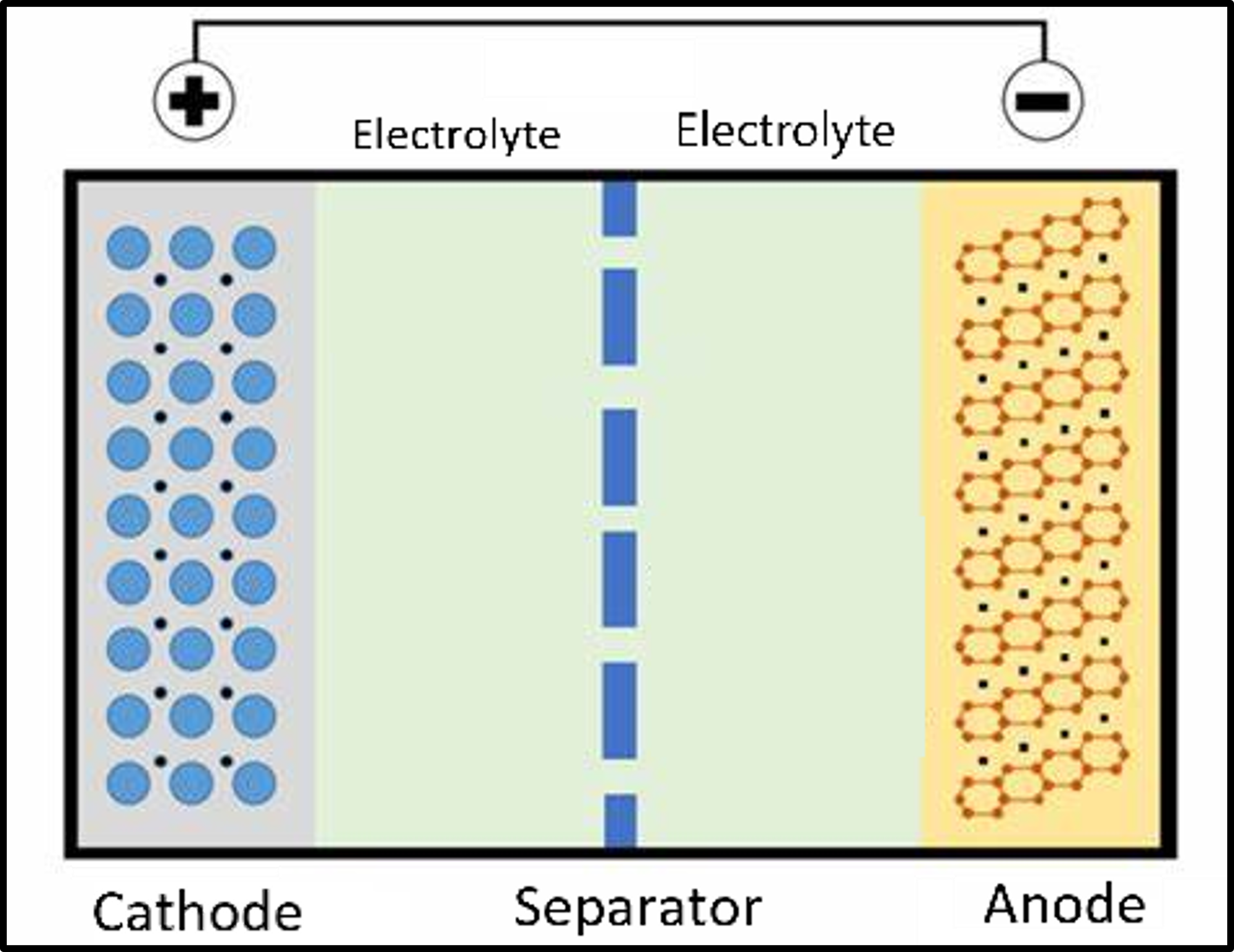
그러나, 우리 스마트폰에 들어있는 리튬 이온 전지는 조금 특별하다. 일반적인 전지는 한번 다 쓰면 땡이지만(1차 전지), 리튬 이온 전지는 방전돼도 다시 충전해서 사용할 수 있는 2차 전지다.
리튬 이온 전지는 환원 전극으로 리튬 코발트 산화물(Lithium Cobalt Oxide)를 사용한다. 그리고, 산화 전극으로 흑연을 쓴다. (우리가 아는 그 연필에 들어있는 흑연이 맞다!) 다른 화학 전지는 산화 전극과 환원 전극이 다른 비커에 담겨 있지만, 리튬 이온 전지는 산화 전극과 환원 전극이 한 전해질로 연결되어있다. 그러나, 산화 전극과 환원 전극이 만나는 순간 폭발(!!!)할 수 있기 때문에 분리막(Separator)으로 서로 분리되어 있다.
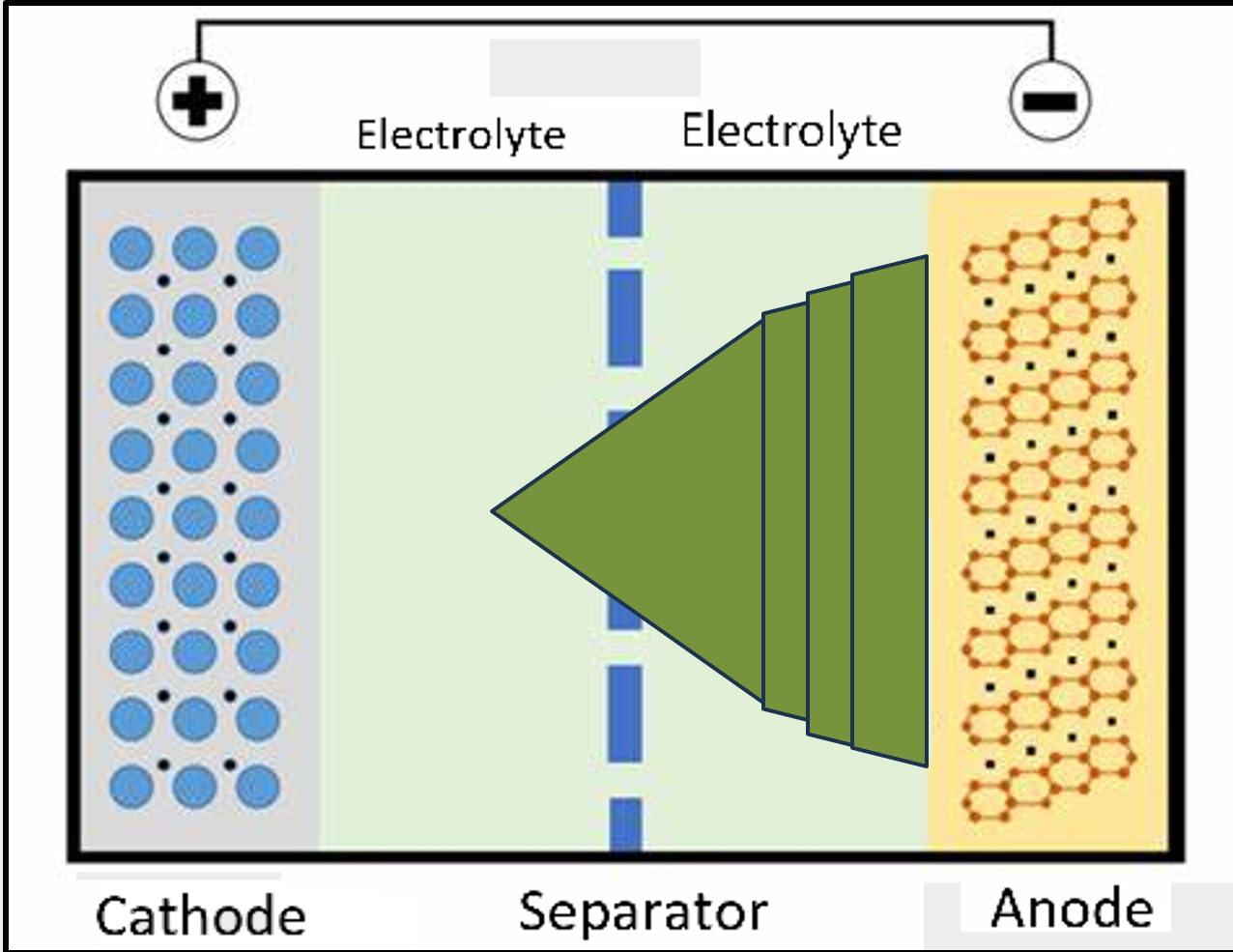
리튬 이온 전지에 전압을 걸면 리튬 이온 전지가 충전된다. 먼저, 환원 전극의 리튬 코발트 산화물에 있던 리튬 이온이 나와 환원 전극에서 산화 전극으로 이동한다. 그리고, 외부 전압에 의해 산화 전극은 전자를 받고, 리튬 이온이 환원되어 리튬 원자가 되며, 흑연 사이사이에 끼여 들어간다.
산화 전극: $C_6 + Li^+ + e^- \rightarrow LiC_6$
환원 전극: $LiCoO_2 \rightarrow CoO_2 + Li^+ + e^-$
이 반면, 리튬 이온 전지에 다른 전자기기를 꼽으면 리튬 이온 전지가 방전된다. 먼저, 산화 전극의 흑연 사이사이에 끼여 있던 리튬 원자가 산화되면서 전자를 방출하고, 리튬 이온이 된다. 그리고, 리튬 이온은 전해질을 타고 분리막을 건너 양극에 도착해 리튬 코발트 산화물에 이온 상태로 삽입된다. 그리고, 방출된 전자는 도선을 따라 흘러, 전류가 발생된다!
산화 전극: $LiC_6 \rightarrow C_6 + Li^+ + e^-$
환원 전극: $CoO_2 + Li^+ + e^- \rightarrow LiCoO_2$
배터리 수명 감소 원인: 과방전과 과충전
이제 매우 긴 서론을 마무리하고, 우리가 알고 싶은 질문인 "왜 우리의 배터리 성능이 쓰면 쓸 수록 나빠질까?"에 답을 해 보자~! 리튬 이온 배터리의 성능이 저하되는 요인에는 오랜 시간 방전된 상태를 유지해 발생하는 "과방전", 완전 충전된 이후에도 계속 전압이 걸릴 때 나타나는 "과충전"의 크게 두 가지가 있다.
먼저, 과충전이 되면 성능이 저하되는 이유에 대해 알아보자. 리튬 이온 전지에 충전을 할 경우, 리튬 이온 배터리의 산화 전극에 리튬 원자가 쌓이게 된다. 그러다가, 흑연이 수용할 수 있는 한계치를 넘어서게 된다면, 리튬 원자가 산화 전극에 비정상적으로 붙게 된다. 따라서, 산화 전극에 뾰족뾰족한 구조물인 덴드라이트(Dendrite)가 생기게 되고, 이게 분리막을 손상시켜 리튬 이온 전지의 성능을 저하시키고, 심할 경우에는 펑! 하고 터질 수도 있다. 이게 스마트폰이나 컴퓨터를 사면 배터리 성능 보존을 위해 80%에서 충전이 멈추는 이유이기도 하다.
그 다음으로 과방전이 된다면 어떤 일이 발생할까? 과방전이 발생된다면 산화 전극의 흑연에 무리가 가게 되고, 산화 전극의 구조가 붕괴된다. 또한, 전해질이 분해되어 기체가 생성돼 배터리의 성능이 저하된다.
그래서 뭘 해야 하는데?
그래서 우리는 배터리 성능을 유지하기 위해 어떤 일을 해야 할까? 답은 간단하다. 배터리를 방전된 채로 너무 오래 두지 말고, 100%가 되었는데도 충전기를 꼽아두지 않으면 된다. 다행히 요즘 스마트폰은 똑똑해서 100%가 되면 지가 알아서 전압 공급을 끊어버린다.
이제 배터리 성능이 떨어지는 이유를 알았으니까, 우리 모두 폰을 잘 돌봐서 배터리를 지켜 보자!



Comments ()